Autophagie
Unter Autophagie versteht man den in Eukaryonten hoch konservierten Prozess des Abbaus zelleigener Bestandteile. Autophagie spielt sowohl beim Basisumsatz von intrazellulären Proteinen und Organellen, als auch bei der Produktion von Aminosäuren unter Hungerbedingungen eine wichtige Rolle. Dabei ist der Beitrag zum Proteinabbau durch Autophagie ähnlich groß wie der des Ubiquitin-Proteasom-Systems. Weiterhin spielt die Autophagie bei der Antigenenpräsentation oder dem Abbau von invasiven Bakterien eine Rolle. Störungen in der Regulation der Autophagie können zu neurodegenerativen Krankheiten, aber auch zu Krebs führen. Während der Autophagie werden die zu degradierenden Proteine und Organellen von einer so genannten Isolationsmembran umschlossen. Die zunächst halbmondförmige Doppelmembran wächst, bis ihre Enden fusionieren und das Autophagosom bilden. Für diesen Prozess sind mehrere Proteine notwendig; darunter Proteine der GABARAP-Familie.
Das GABA-Rezeptor-assoziierte Protein (GABARAP) gehört zu einer Proteinfamilie, die an intrazellulären Transportprozessen sowie an der Autophagie beteiligt ist. Sie umfasst mehrere humane Mitglieder, wie GABARAP und MAP LC3 (microtubule-associated protein 1 light chain 3), aber auch das Hefeprotein Atg8 (autophagy-related protein 8).
GABARAP wurde ursprünglich als Ligand des Rezeptors für γ-Aminobuttersäure (GABA) vom Typ A (GABAA-Rezeptor) entdeckt. Mittlerweile ist aber klar, dass GABARAP eine viel wichtigere und allgemeinere Funktion in allgemeinen Vesikeltransportvorgängen spielt, ganz besonders während der Autophagie.
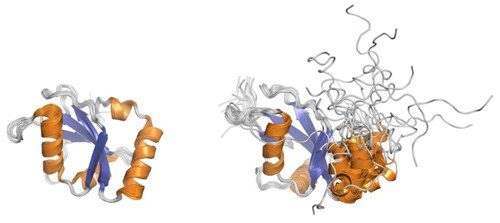
Wir waren die Ersten, die sowohl die Lösungsstruktur des humanen Proteins GABARAP, als auch die Lösungsstruktur des Hefeproteins Atg8 bestimmt haben. Sie zeigen die für Mitglieder der Ubiquitin-Superfamilie bekannte Struktur, die durch die so genannte β-grasp Faltung charakterisiert wird. Sie besteht aus einem zentralen vier-strängigem β-Faltblatt mit zwei α-Helices an dessen konkaver Seite. Eine Besonderheit der GABARAP Familie ist eine N-terminale Verlängerung mit zwei zusätzlichen α-Helices, die an der konvexen Seite des β-Blattes lokalisiert sind. Diese N-terminale Domäne zeigt bei Atg8 konformationelle Flexibilität auf der Mikro- bis Millisekunden-Zeitskala. Dahingegen weißt der N-Terminus von GABARAP eine direkte Interaktion mit dem C-Terminus auf.
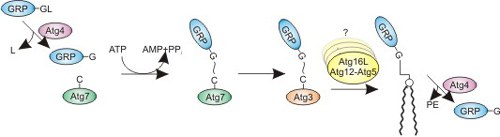
GABARAP und GABARAP-homologe Proteine können in der Zelle reversibel lipidiert und an Membranen verankert werden. Dieses und die konformationelle Flexibilität in der N-terminalen Region können potentiell die Oligomerisierung von lipidiertem Protein begünstigen und so beispielsweise die Bildung von Autophagosomen erleichtern.
Arbeitsgruppe Weiergräber: GABARAP-ein Protein an der Schnittstelle zwischen Autophagie und Apoptose
